東大など、数十年来の脳の謎を解明 - 脳回路が精密な配線であることを発見 [2012/01/20]
科学技術振興機構(JST)と東京大学は1月20日、脳の神経回路が、回路を形成する神経細胞「ニューロン」(画像1)より小さく、「シナプス」の単位で正確に編まれることで機能を発揮することを明らかにしたと発表した。東京大学大学院薬学系研究科の池谷裕二准教授らの研究グループによる発見で、成果は米科学誌「Science」に米国東部時間1月20日に掲載された。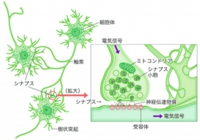 画像1。ニューロンとシナプスの基本構造。ニューロンは、樹状突起が広がる細胞体部分と、そこから長く伸びる軸索とで構成され、ほかのニューロンから受け取った情報を処理して、ほかのニューロンに伝えていく。シナプス部分では、神経伝達物質を使って情報をほかのニューロンに伝える
画像1。ニューロンとシナプスの基本構造。ニューロンは、樹状突起が広がる細胞体部分と、そこから長く伸びる軸索とで構成され、ほかのニューロンから受け取った情報を処理して、ほかのニューロンに伝えていく。シナプス部分では、神経伝達物質を使って情報をほかのニューロンに伝える
脳はニューロンと呼ばれる神経細胞からなり、各々のニューロンが、少しずつ情報を処理している。その処理結果は、ニューロン間の特殊な結合であるシナプスを介して、次のニューロンに伝えられる(画像1)。
ニューロンには多くの樹状突起と呼ばれる枝分かれした線維があり、ここにあるシナプスは、樹状突起の先端部分「スパイン」と呼ばれる突出構造を介してほかのニューロンからの情報を受け取る仕組みだ。樹状突起は複雑に分岐するだけでなく、種々の「イオンチャネル」(細胞膜や内膜など、細胞の生体膜にある膜貫通タンパク質の一種で、受動的にイオンを透過させるタンパク質の総称)や「受容体」(生物の体にあって、外界や体内からの何らかの刺激を受け取り、情報として利用できるように変換する仕組みを持った構造のこと)を持つため、「どのスパインが、いつ、どんな入力を受けたのか」が、ニューロンの情報処理に大きく影響する。
ニューロンは主として樹状突起からの入力を受けるが、樹状突起上のシナプス配置のパターンについては、現在、2つの仮説が提唱されている(画像2)。1つは、同期した入力(ほぼ同時刻に来る入力)は樹状突起上のある特定の箇所に集中するという「クラスター入力モデル」(仮説1)で、もう1つは、同期した入力が樹状突起全体に散在している「分散入力モデル」(仮説2)だ。
仮説1はニューロンの一部を強く活動させるためには有利とされているが、仮説2は情報のロスが少ないという利点がある。いずれのモデルが正しいのかについては、数十年来の議論の的となっているものの、これを検証するための実験技術がなかったため、これまでに明確な回答は得られていなかったというわけだ。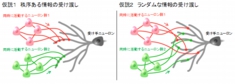 画像2。今回の研究は、2つの仮説のうち仮説1が正しいことを証明した。左図では、同期するニューロン仲間が、相手ニューロンの線維の近くに集中的に投射している。右図では、そのような秩序は見られない。このどちらの図が正しいかが、長らく議論の的になっていた
画像2。今回の研究は、2つの仮説のうち仮説1が正しいことを証明した。左図では、同期するニューロン仲間が、相手ニューロンの線維の近くに集中的に投射している。右図では、そのような秩序は見られない。このどちらの図が正しいかが、長らく議論の的になっていた
活動している神経細胞を観測するために現在広く利用されている手法は、「カルシウムイメージング法」と呼ばれるものだ。活動している神経細胞を検出するため、活動時に細胞内で遊離されるカルシウムイオンの存在により蛍光を発する色素(カルシウム蛍光指示薬)を用いる仕組みである。
しかし、この蛍光は微弱なため、従来の手法では強いレーザー光を当てることによって観察中に細胞が死んでしまうのを回避することができないという欠点があった。そこで今回、池谷准教授らは、抗酸化剤を用いることで死滅する細胞を減らし、また光透過性の高い光学レンズと高感度なデジタルカメラを用いるなど、多くの改良を行い、「大規模スパインイメージング法」を開発。その結果、多数のシナプスから一斉にカルシウム活動を計測することができるようになったという次第だ。
この手法をもとに、まずステップ1として海馬のスライス培養標本のニューロン内にカルシウム蛍光指示薬を注入し(画像3)、多くのスパインからの蛍光変化を高感度CCDカメラにより同時に記録することで、「どのスパインが、いつ、どんな入力を受けたのか」を調べた。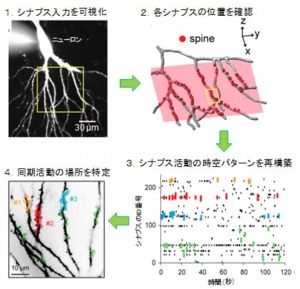 画像3。新たに確立されたスパインイメージング法。ステップ1:シナプス入力をスパインのカルシウム活動として撮影。ステップ2:撮影後にスパインの位置を3次元的に再構築して、各シナプスの距離を測定。ステップ3:活動パターンを図に表して、時空構造(特に同期活動)を解析。ステップ4:同期活動したシナプスを空間プロットした結果、近傍のシナプスが同時に活動することが判明した
画像3。新たに確立されたスパインイメージング法。ステップ1:シナプス入力をスパインのカルシウム活動として撮影。ステップ2:撮影後にスパインの位置を3次元的に再構築して、各シナプスの距離を測定。ステップ3:活動パターンを図に表して、時空構造(特に同期活動)を解析。ステップ4:同期活動したシナプスを空間プロットした結果、近傍のシナプスが同時に活動することが判明した
従来は数個のスパインを観察するのが限界だったが、「大規模スパインイメージング法」により、同時に数百個ものスパインからシナプス活動を計測することができるようになった。これは過去の記録を2桁更新するもので、これにより、広い範囲のシナプス活動を、時間を追って観察することができるようになったという。
シナプス活動を観察したところ、近傍のスパインがしばしば同時に活動していることが判明。統計解析を行った結果、8μm以内の近接スパインが有意に同期活動しやすいことが見出された。この現象は、世界で初めて確認されたものであるという。
この空間的に集まった同期活動を「クラスター入力」と呼ぶが、同入力は、海馬スライス培養標本のみならず、生体内の大脳皮質でも確認できたことから、海馬だけの特殊な現象ではなく、脳部位を超えて広く観察される現象であるという考えである。
なお、クラスター入力を生むためには、神経回路はシナプスレベルで正確に編まれている必要がある(画像2・左)。観察の結果、クラスター入力を受けるスパインは、そうでないスパインに比べて大きいことが確認された。
スパインの大きさは、LTP(シナプス可塑性の一種で記憶の素過程と考えられている)を経験したかどうかに関連するほか、シナプス結合の強さとも相関していることが確認され、このことからクラスター入力はLTPの結果として生じていることが示唆された次第である。
実際、海馬シナプス培養標本を「NMDA受容体」(LTP形成に関与する分子)の阻害薬で処置して培養したところ、クラスター入力は観察されなかったとのことで、これらの結果から、クラスター入力は、NMDA受容体を介したシナプス回路の編成の結果、生じることがわかってきたのである。
そこで、LTPが樹状突起でどのような空間パターンで生じるかを、遺伝子改変動物を用いて解析したという。「AMPA受容体」はグルタミン酸受容体の一種で、グルタミン酸を用いるシナプスでは最も主要な受容体で、この受容体の数がシナプス結合の強さを決定し、学習によって増減する。また、LTPに伴ってスパインに運ばれることも知られている。
さらに、AMPA受容体とGFPが結合した遺伝子に、任意のタイミングで発現させることができる工夫を加えた遺伝子をマウスに導入して実験を行った。同マウスを、先の遺伝子を発現させないまま育て、ある時、育った環境と異なる新しい環境へ置き、500秒間自由に探索させる。すると新しい環境下において、マウスはさまざまな学習をする必要があるため脳内でLTPが発生。この実験の直前に先の遺伝子を発現させておくことで、この学習の結果起こったLTPだけを観察することが可能となる仕組みで、その実験結果(画像4)を解析したところ、互いに近いところにあるスパイン群でLTPが生じていたことが判明したという。
これはLTPが隣接したシナプスで生じやすいことを世界で初めて示したものだとのことで、今回の実験結果を、これまでの回路発達に関する知見も踏まえて考察すると、クラスター入力は3つのステップによって成立していると推定されるとの結論に至ったという(画像5)。すなわち、(1)まずはランダムに回路が作られる、(2)シナプスの要・不要が判定される、(3)不要なシナプスが削り取られるという順次過程だ。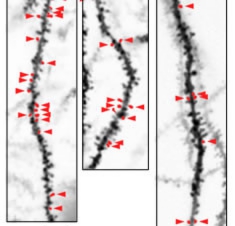 画像4。シナプス可塑性(LTP)が近傍のスパインで生じることを、遺伝子改変マウスを用いて示したもの。赤の矢尻で示されているものがLTPの生じたスパイン
画像4。シナプス可塑性(LTP)が近傍のスパインで生じることを、遺伝子改変マウスを用いて示したもの。赤の矢尻で示されているものがLTPの生じたスパイン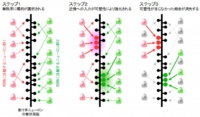 画像5。クラスター入力を生じさせるために想定される3つのステップを示した。ステップ1:初期のニューロン回路では、結合相手の選定は無秩序である。ステップ2:たまたま近くに同期入力を与えるような結合ができた場合、LTPが生じて強化される。ステップ3:強化されなかったシナプスが消えることで、図2の仮説1のような回路が残存する
画像5。クラスター入力を生じさせるために想定される3つのステップを示した。ステップ1:初期のニューロン回路では、結合相手の選定は無秩序である。ステップ2:たまたま近くに同期入力を与えるような結合ができた場合、LTPが生じて強化される。ステップ3:強化されなかったシナプスが消えることで、図2の仮説1のような回路が残存する
今回発見された局所的なLTPは、ステップ2に貢献すると考えられている。その後、ステップ3の淘汰過程を経ることで、クラスター入力を生み出す回路が選択的に残るものと考えられる結論となった。
今回の研究で、同期した神経入力が互いに近傍にあるシナプスに収束することが示されたことから、脳内の情報の流れが驚くほど正確に制御されていることを示すことが判明。図2の仮説1が正しいことが支持され、数十年に及んだ神経科学界の重要な議論に1つのめどがついたといえる。
クラスター入力は、樹状突起上での非線形的な加算を促すため、「個々のニューロンが持つ演算能力を高める」ことに役立つと考えられるという。この演算能力が可塑性によって生じることから、クラスター入力は記憶・学習能に関わる基本的な生理メカニズムであると思われる。池谷准教授は、今後、認知症や統合失調症、うつ病など、記憶の変調を伴う疾患において、クラスター入力がどう変化しているかを観察していくという新たなアプローチが、精神神経疾患の病態に有益な解釈をもたらすと期待されるとコメントしている。




