産総研、老化した脳でも外的刺激で神経細胞の産出機能が増加することを確認 [2011/08/10]
「学習」と「記憶」の能力を司る脳内の「海馬」は神経幹細胞が存在し、大人になっても新しい神経細胞が絶えず作られているが、老化に伴い海馬の神経幹細胞の数は減少し、同時に多様な神経細胞群を生み出す能力も減衰していくが、産業技術総合研究所(産総研)などの研究チームは、海馬で神経細胞の最下層を形成している細胞(アストロサイト細胞)が老化した脳内でも運動などの生体の外から与える刺激により、分泌型のたんぱく質の1つで、細胞運命の調節や様々な発生、発がんなどに関わっているとされている情報伝達(シグナル伝達)に使われる「Wnt3」の産生量を増加させ、それにより神経新生機能を向上させることを突き止めた。
同成果は、産業技術総合研究所(産総研)の浅島誠フェローと同幹細胞工学研究センター 幹細胞制御研究チームの桑原知子研究員は、筑波大学 人間総合科学研究科の征矢英昭教授らによるもので、実験生物学に関する米国の科学誌「FASEB Journal」に掲載された。
人間の脳内にある海馬では、生涯にわたり新しい神経細胞が産み出されている(神経新生)が、その頻度は年齢とともに減少し、ストレスや疾患など個人がおかれた環境によっても大きく変化する。アルツハイマー病、認知症、うつ病などの神経変性疾患や精神疾患では、海馬の神経新生現象がさらに顕著に低下するが、これは海馬の神経新生現象が、外的刺激や個人の生体環境によって容易に変化し得る分子メカニズムで調節されていることを示しており、この「外的刺激」には、海馬での新しい神経細胞のネットワーク形成を増加させるもの(例えば、運動、玩具を配置するなどの豊かな生育環境作りなど)もあれば、減少させるもの(例えば、ストレス、疾患、老化など)もあり、それらに応答して数多くの遺伝子の発現様式が多様に変化することが分かってきていた。
産総研では、脳内にある神経幹細胞を解析し、アルツハイマー病やうつ病の医療・創薬開発に役立てる研究を行ってきており、これまでにアストロサイト細胞の産生するWnt3が神経新生の起点になること、すなわちWnt3のシグナル伝達によって、神経分化に必要となるNeuroD1遺伝子や、神経細胞の多様化を産み出すレトロトランスポゾンの遺伝子が活性化することを見出していた。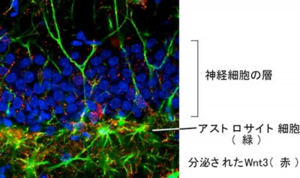 海馬における神経新生。アストロサイト細胞が分泌するWnt3により神経幹細胞から神経細胞が産み出される
海馬における神経新生。アストロサイト細胞が分泌するWnt3により神経幹細胞から神経細胞が産み出される
これは「神経新生」の基本となるメカニズムを明らかにしたものだが、今回の研究では、疾患や老化といった個体の現象と、脳内の神経幹細胞やその周囲の細胞がどのように関係しているのか、それぞれについて詳細に調べまたほか、その研究の過程で、機能が損なわれた細胞を、再び活性化させるには、どの分子が中心として働くのかを検証するために、マウスを用いて「運動」効果を調べる実験も行った。また、筑波大学では、脳の認知機能を増強するような運動処方の開発を目指す研究をしており、産総研幹細胞工学研究センターにおいて、神経幹細胞を用いてその分子基盤について解析を行った。
具体的には、老齢マウスの海馬と若齢マウスの海馬から「神経幹細胞」をそれぞれ樹立・培養したところ、試験管内の独立した実験環境では、神経幹細胞の増殖能力や遺伝子発現プロファイルに大きな差異がないことが分かった。これは、神経幹細胞を培養する過程で加える栄養因子の効果によるものと考えられ、この結果は、外から加える因子によって老化した神経幹細胞でも、若い神経幹細胞と同じような状態へと導けることを示すもので、これにより神経幹細胞自体の潜在的な神経新生能力そのものは、老化によっても根本的に損なわれていない可能性が示唆されたこととなる。
また、老齢マウスの海馬と若齢マウスの海馬から「アストロサイト細胞」をそれぞれ樹立・培養すると、老齢マウスの海馬「アストロサイト細胞」培養系では、若齢マウスの海馬「アストロサイト細胞」に比べるとWnt3産生能力が30分の1程度と大幅に減少していることが判明した。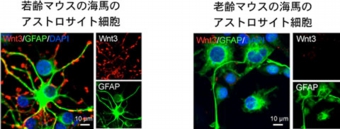 若齢マウスの海馬より抽出し、培養したアストロサイト細胞(左)。老齢マウスの海馬より抽出・培養したアストロサイト細胞(右)。アストロサイト細胞のマーカーであるGFAP(緑:抗体染色)はどちらも同様に発現している。若齢マウスの海馬アストロサイト細胞(左)からは、Wnt3(赤:抗体染色)が盛んに産生されているが、老齢マウスの海馬アストロサイト細胞(右)からは、Wnt3の分泌がほとんど観察されない
若齢マウスの海馬より抽出し、培養したアストロサイト細胞(左)。老齢マウスの海馬より抽出・培養したアストロサイト細胞(右)。アストロサイト細胞のマーカーであるGFAP(緑:抗体染色)はどちらも同様に発現している。若齢マウスの海馬アストロサイト細胞(左)からは、Wnt3(赤:抗体染色)が盛んに産生されているが、老齢マウスの海馬アストロサイト細胞(右)からは、Wnt3の分泌がほとんど観察されない
さらに、老齢マウス群に、ストレスを感じさせない程度の運動(ランニング)を短期間行わせると、海馬アストロサイト細胞のWnt3産生能が大幅に増加したことが確認され、この分泌されたWnt3の増加に伴って、それを受け取る神経幹細胞内の神経分化に必要な遺伝子が活性化され、神経新生機能が増すこと、すなわち海馬で新しく産み出される神経細胞の数が増加することが判明した。
海馬で新しく神経細胞が作られる過程には、「神経細胞の多様性(特異性の獲得)」を引き起こすメカニズムが備わっている。海馬の多様な神経細胞では、同じ神経特異的遺伝子でも、それぞれ微妙に異なった発現プロファイルを持っており、海馬の細胞内で発現する各遺伝子の量を調節するクロマチン制御では、他の細胞と異なり、ゲノムのノンコーディング領域に含まれるレトロトランスポゾンが、様々な遺伝子の近くで活性化されることでクロマチン制御に違いが生じ、それにより神経細胞の多様性が産みださえるという特長がある。この仕組みが、運動(ランニング)といった個体への刺激で、どのように変化するのか調べた結果、新しく産まれた神経細胞内のレトロトランスポゾンのクロマチン制御の状態が、アストロサイト細胞が産生するWnt3の量に、敏感に依存していることが判明した。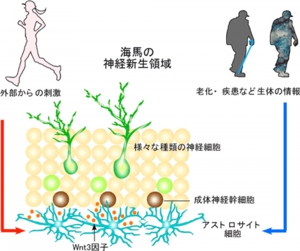 個体の情報を神経幹細胞へ伝える因子(Wnt3:オレンジ)。神経幹細胞内の遺伝子発現や、神経細胞の多様性を産み出す分子メカニズム自体は変わらないが、アストロサイト細胞のWnt3産生能は個体の状態に大きく依存する
個体の情報を神経幹細胞へ伝える因子(Wnt3:オレンジ)。神経幹細胞内の遺伝子発現や、神経細胞の多様性を産み出す分子メカニズム自体は変わらないが、アストロサイト細胞のWnt3産生能は個体の状態に大きく依存する
これまで、老化により脳内で新しい神経が作られなくなるのは、元となる「神経幹細胞」の数が減ってしまうことが第一の原因と考えられきたが、今回の結果は、「神経幹細胞」ではなくアストロサイト細胞に神経新生を大きく左右する因子があり、それが「神経幹細胞」の若返りにもつながる役割を持っていることを明らかにしたものとなる。
脳内の神経新生を上昇させる外的刺激(運動)と、減少させる状況(老化、疾患)との双方の変化に即して、広範なゲノム応答をオン/オフする分子機構が見つかってきたことは、今後の神経・精神疾患の創薬・医療への新たなアプローチの基盤となる知見が確かめられたと考えられると研究チームでは説明しており、老化や様々な神経疾患の状態を左右する、幹細胞の周囲の細胞の役割を今後さらに解析し、診断に有効な新しい分子マーカーの検出方法を探索する予定とするほか、幹細胞自体を操作しなくても、幹細胞を支えている細胞群の活性化を促すような創薬開発や新規医療技術の開発など、今後の多様な産業に応用させていければ、としている。




